研究場所:海南師範大學,海口市熱帶特色藥食同源植物研究與開發重點實驗室 研究地點:海南 海口
摘 要
研究明日葉根的黃酮類化合物的提取,分離以及與 DNA 相互作用的光譜研究。在 pH 為 7.2 的 Tris-HCl 緩衝溶液體系中,應用螢光光譜法和紫外光譜技術研究明日葉根黃酮和 DNA 復合物分子間的相互作用;利用 Stem-Volmer方程探討明日葉根黃酮對 DNA 的螢光猝滅機制,計算出熱力學參數。結果表明:DNA 與明日葉根黃酮之間存在較強的相互作用,25 ℃時結合常數為 5.35 × 105 L/mol,熱力學參數 r Ssm= 97.5 J/Kmol,r Gsm= -3.32 × 104 J/mol,r Hsm= -4.147 ×103 J/mol 表明黃酮分子與 DNA 作用以氫鍵和範德華力為主,通過嵌插結合的方式。
關鍵詞:明日葉;黃酮;DNA;螢光猝滅;機制
Spectrometry on Interaction between Angelica keiskei Roots Flavone and DNA
Hainan Normal University,Haikou Key Laboratory of Topical & Special Medicine and Edible Plant in Research and Development,Haikou 571127,Hainan,China
Abstract(英文摘要)
Flavone was extracted and separated from Angelica keiskei root alcohol extracts and the interaction mechanism between angelica keiskei roots flavone and DNA was studied using UV spectrometry and fluorescence spectrometry. The quenching mechanism of fluorescence and the thermodynamic parameters of the complex was discussed .The results showed that there were strong interaction between angelica keiskei roots flavone and DNA.
The binding constant was 5.35×105L/mol at 298 Kand the thermodynamic parameters of the complex were △r Ssm=97.5 J/Kmol, △r Gsm= -3.32 × 104 J/mol, △r Hsm= -4.147 × 103 J/mol. The interacting forces were mainly hydrop Hobic interactions and hydrogen bonds between flavone and DNA.This study could provide important information for further study about the p Harmacological activity of angelica keiskei roots flavone.
Key words:Angelica keiskei; flavone; DNA; fluorescence quenching; mechanism
明日葉 Angelica keiskei 別名明日草[1]、八丈草,含有人體所必需的各種維生素、礦物質,其根莖中含有豐富的天然黃酮(flavonoid)和香豆素(Coumarin),這些物質具有抗菌、抗癌作用。
通常認為,脫氧核糖核酸(DNA)是重要的遺傳物質,與藥物分子的相互作用會影響到 DNA 轉錄和翻譯[2],從而引起活細胞的物理化學性質和生理功能的改變,起到抗癌[3]或者藥效作用,因此眾多學者開始致力於研究藥物分子與 DNA 的相互作用。
目前,通常對藥物分子通過溝槽或是嵌插結合在核酸的螺旋溝或鹼基中,誘發許多生物效應,阻礙核酸信息的正常表達,特別是嵌插作用,或直接抑制 DNA 的複製和轉錄功能;或在經過進一步活化後,使 DNA 斷裂受損而影響其功能。
研究藥物小分子與DNA 的相互作用機制,有利於瞭解藥物的作用機理,進而為新藥設計和篩選提供有價值的信息[4]。
有關明日葉根的黃酮類化合物與 DNA 相互作用的光譜分析尚未見報道,本文通過對明日葉根某些黃酮類化合物與 DNA 相互作用機制的研究,旨在為明日葉藥理活性的研究和利用提供有價值的信息,同時對高效、低毒天然藥物的設計與開發具有一定的指導意義。
1 材料與方法
1.1 儀器和試劑
高效液相色譜儀:大連依利特分析儀器有限公司;RF-5301 螢光分光光度儀:日本島津公司;明日葉根:青島;鯡魚:DNA Sigma 公司;薄層色譜板 Kieselgel 60 F254:Merck 公司;其餘試劑均為分析純。
1.2 明日葉根黃酮的分離與純化
取明日葉根洗淨、粉碎,過 100 目篩,分別稱取100 g 粉末按料液比 1 ∶ 10 的比例加入 75 %的乙醇,浸泡 24 h 後過濾,濾渣用 75 %的乙醇重新處理三次,合併濾液,得到明日葉根黃酮初提液。用石油醚浸泡12 h,以除去脂溶性物質,過濾,得到下層黃色液體,減壓濃縮,得到黃色膏狀提取物,低溫保存。
將明日葉根黃酮膏狀提取物用層析硅膠(100 目)拌樣,經正相硅膠柱層析分離,以 90 %甲醇進行梯度洗脫,每 10 min 接一次樣,後通過薄層層析色譜追蹤,合併斑點相同的組分,得到(A-G)7 個餾分。
將 G 餾分濃縮用層析硅膠(100 目)拌樣,經硅膠柱層析用正己烷-乙酸乙酯 2 ∶ 1 梯度洗脫,每 5 min 接一次樣,經薄層層析色譜追蹤後合併斑點相同組分得到(G1-7)7 個餾分,取 G7 餾分,得到黃酮提取物。
1.3 明日葉根黃酮提取物與 DNA 相互作用的光譜研究
1.3.1 DNA 猝滅實驗
在 4 個 10 m L 容量瓶中,依次分別加入固定量明日葉根黃酮溶液和不同量的 DNA 溶液,隨後均加入固定量的 p H=7.2 的 Tris-HCl 緩衝溶液並用二次蒸餾水定容至刻度,搖勻,在螢光儀上進行螢光光譜和吸收光譜的測定。螢光激發波長為 368 nm,發射波長為450 nm,狹縫寬均為 5 nm。
1.3.2 UV-vis 光譜
在 4 個 10 m L 的容量瓶中,分別加入固定量的Tris-HCl 緩衝溶液和固定量的 DNA 溶液,隨後分別加入不同量的明日葉根黃酮溶液並用二次蒸餾水定容至刻度,搖勻,放置 10 min 後進行紫外光譜測定。
2 結果
2.1 明日葉根黃酮提取物對 DNA 紫外吸收光譜的影響
一般而言,化合物與 DNA 如果存在相互作用就必然會在吸收光譜中有所反映,因為具有雙螺旋結構的 DNA 分子中由於含有芳香性鹼基與磷酸生色團而在 260 nm 左右存在一強烈的吸收。DNA 的鹼基是許多藥物與 DNA 作用的位點,藥物與 DNA 結合將引起DNA 特徵吸收峰的變化,見圖 1。
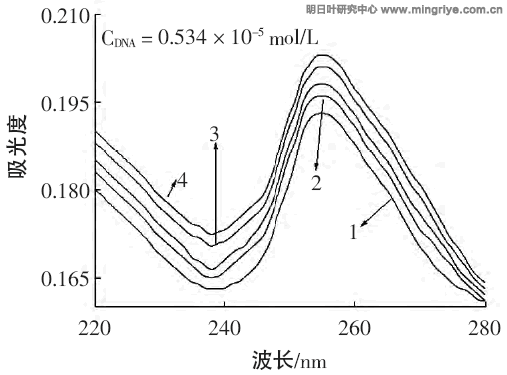
圖1 不同明日葉根黃酮濃度下的紫外吸收光譜
Fig.1 The ultraviolet absorption spectrum of interaction between different concentrations of Angelica keiskei roots flavone
從圖 1 可以發現,隨著溶液中明日葉根黃酮濃度的逐漸增大,DNA 的紫外吸收光譜出現了增色效應和紅移現象,這種增色效應是由於嵌插劑嵌入核酸雙螺旋結構中,並且嵌入劑可在兩個鹼基對之間滑動,從而降低了與核酸的超螺旋程度密切相關的鏈環數,使得超螺旋的緊密結構變成較為松馳的狀態[5]。Long 理論認為紅移現象是小分子與 DNA 發生嵌插作用的標誌,由此可以初步推斷明日葉根黃酮分子可能嵌插進DNA 的鹼基對中,結合到 DNA 的親核位點,引起了紫外吸收官能團的改變[6-7]。
2.2 DNA 存在下明日葉根黃酮提取物的螢光光譜
圖2 為DNA 存在下明日葉根黃酮的螢光發射光譜。

圖2 DNA 存在下明日葉根黃酮提取物的螢光光譜
Fig. 2 Fluorescence spectrum of interaction between different concentrations of Angelica keiskei roots flavone
從圖2 中可以看出,明日葉根黃酮在450 nm(λex=368 nm)處有一最大發射峰。DNA 的存在可使明日葉根黃酮最大螢光發射峰的螢光強度發生猝滅。當DNA 濃度逐漸增大時,猝滅程度逐漸增強。表明DNA和明日葉根黃酮可能形成了復合物。
2.3 猝滅機制
由螢光猝滅的Stem-Volmer 方程:
F0/F = 1 + KSVC (1)
式中:F0 為未加入猝滅劑時螢光物質的螢光強度;F 為猝滅劑濃度等於C 時螢光物質的螢光強度;KSV 為Stem-Volmer 猝滅常數[8-10],(L/mol)。
求出在298 K 時,DNA 對明日葉根黃酮的Stem-Volmer 猝滅常數KSV 為0.94×103 L/mol,同時溫度升高,其KSV 為0.93×103 L/mol。如果對動態猝滅來說,其猝滅常數隨溫度升高將會升高,因此上述結果表明DNA 對明日葉根黃酮的螢光猝滅不是由於分子間動態碰撞,而是靜態猝滅。
2.4 DNA 與明日葉根黃酮提取物二元絡合物的組成及其結合常數
靜態螢光強度與猝滅劑的關係[7],如公式(2)所示。
lg[(F0 – F)/F] = lgK + nlg[C] (2)
式中:F0 與F 分別代表未加入和加入DNA 時的螢光強度;K 為明日葉根黃酮與猝滅劑之間的結合常數,(L/mol);C 為猝滅劑DNA 的濃度;n 為結合位點數。
由式(2)分別作出明日葉根黃酮-DNA 體系的關係圖(圖3)。
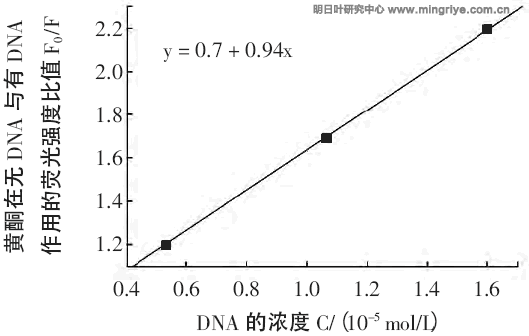
Fig.3 F0/F-C working curve in the different concentrations of Angelica keiskei Roots flavone and DNA system at 25 ℃
注:黃酮濃度為2.3×10-5 mol/L。
通過斜率和外推截距可以求出明日葉根黃酮與猝滅劑之間的結合常數。25 ℃時明日葉根黃酮與DNA之間的結合常數為5.35×105 L/mol,經典插入方式是與結合DNA 的溴化乙錠的結合常數為4.9×105,這說明明日葉根黃酮提取物與DNA 主要以插入方式。
![圖4 303 K 和298 K 下明日葉根黃酮-DNA 體系的lg[(F0-F)/F]-lg[C]工作曲線](https://zh-hant.mingriye.com.cn/wp-content/uploads/2016/12/mingriye-huangtong-dna-4.png)
DNA 的濃度,10-5 mol/L。
圖4 303 K 和298 K 下明日葉根黃酮-DNA 體系的lg[(F0-F)/F]-lg[C]工作曲線
Fig.4 lg(F0 – F)/F – lg [C] working curve in the system of Angelica keiskei roots flavone and DNA at 303 K and 298 K
小分子和大分子之間作用力包括氫鍵,範德華力,靜電引力和疏水作用,熱力學參數焓變△rHsm,熵變△rSsm 和自由能△rGsm 決定熱力學模式,熱力學有關參數計算公式[11]如下:
△rHsm = [2.303RT1T2/( T2 – T1)] [log (K2/K1)]
△rGsm = -2.303RT log K = △rHsm – T△rSsm
表1 可以知道熱力學參數,△rHsm,熵變表示分子之間的氫鍵和範德華力作用強弱,△r Ssm 表示分子之間的疏水作用,△rGsm 越負說明反應自發進行。
| 表1 結合反應的熱力學參數
Table 1 Thermodynamics parameters in binding reaction |
|||
| 溫度/K | rHsm /(J/mol) | rSsm /(J/Kmol) | rGsm /(J/mol) |
| 298 | -4.147×103 | 97.5 | -3.32×104 |
| 303 | -4.147×103 | 97.5 | -3.26×104 |
表1 說明,明日葉根黃酮與DNA 結合作用力以分子之間的氫鍵和範德華力為主。
3 結論
用螢光法[11]和紫外吸收光譜法研究了DNA 與明日葉根黃酮的相互作用,明日葉根黃酮在450 nm(λex=368 nm)處有一最大發射峰。DNA 的存在可使明日葉根黃酮最大螢光發射峰的螢光強度發生猝滅。當DNA濃度逐漸增大時,猝滅程度逐漸增強。
DNA 與明日葉根黃酮之間存在較強的相互作用,25 ℃時結合常數為5.35×105 L/mol 結合方式是明日葉根黃酮通過插入方式與DNA 結合,他們之間主要靠分
子之間的氫鍵和範德華力。
參考文獻
[1] 張玉芳.明日葉品質管制之研究[D].台灣:中國醫藥學院中國藥學研究所碩士論文,2001
[2] Diculescu V C, Chiorcea Paquim A M,Oliveira Brett A M. Electrochemical DNA Sensors for Detection of DNA Damage [J].Sensors,2005(5):377-393
[3] Vrána O, Brabec V.Electrochemical analysis of antitumour platinum drugs and their complexes with DNA[J]. Journal of Electroanalytical Chemistry and Interfacial Electro-chemistry,1988, 253: 145-160
[4] 廖見培,黃彬生.DNA 與小分子藥物相互作用研究進展[J].化學傳感器,2005,25(1):1-5
[5] 郭金保,張國文.藥用植物活性成分黃酮類化合物與核酸作用機制的研究[D].南昌大學,2008
[6] 盧繼新,張貴珠,黃志娜,等. 巰嘌呤金屬配合物與小牛胸腺DNA的作用[J].化學學報,2002, 60(6):967-972
[7] 馮喜增,金瑞祥.各種離子對血卟啉與牛血清白蛋白相互結合反應的影響研究[J].高等學校化學學報,1996,17(6):866-869
[8] 劉煒,畢和平,張連華,等.阿司匹林與DNA 相互作用的光譜研究[J].安徽農業科學, 2009,37(15):6837-6838
[9] 段雲青,閔順耕.溴鼠靈與DNA 作用機制的光譜研究[J].光譜學與光譜分析,2009,29(4):999-1003
[10] 鄧勝國,鄧澤元,範亞葦,等.荷葉中紫雲英苷和DNA 相互作用的光譜學研究[J]. 光譜學與光譜分析, 2010(2): 190-194
[11] Zhang S,Ling B,Qu F, et al. Investigation on the interaction between luteolin and calf thymus DNA by spectroscopic techniques [J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2012, 97:521-525
*基金項目:海口市應用技術研究與開發項目 (2014-90);海南省高等學校科學研究基金項目 (Hjkj2012-22);海南省省級創新訓練項目(2013116580);海南省高等學校優秀中青年骨幹教師培育項目
*作者簡介:劉紅(1967—),女(漢),教授,碩士生導師,博士,主要研究領域:天然產物分離新技術。

發佈留言