研究地點:成都市衛生防疫站,四川成都,610021
摘 要
目的:
評估明日葉保健茶的毒性及致突變性和致畸性。
方法:
採用急性毒性試驗、Ames試驗、微核試驗、小鼠精子畸形試驗、骨髓細胞染色體畸變試驗、30d餵養試驗和傳統致畸試驗等。
結果:
急性毒性試驗為實際無毒級;致突變試驗為陰性;在30d餵養試驗中,未見引起大鼠的整體健康狀況、生理生化功能和器官組織形態學各重要指標的異常變化;在傳統致畸試驗中未見發育毒性。
結論:
「明日葉保健茶」在推薦劑量[3g/(d•人)]下,食用是安全的。
關鍵詞:明日葉;致突變性;致畸性
「明日葉」學名叫AngelicaKeiskeiKoidzumi。原產地在日本八丈島,島民多食用明日葉,均很長壽,因此又名長壽草。明日葉具有提高機體免疫力、潤腸通便、改善睡眠、延緩衰老等多重功效,具有廣泛的開發和應用價值。因此,某研究所開展了長壽草的引種工作,並開發出保健茶等。為確保食用人群的健康,本文按《食品安全性毒理學評價程序和方法》[1]的相關要求,對「明日葉保健茶」的毒性進行了系統的研究。
1 材料與方法
1.1 受試物
明日葉保健茶由四川佳壽康復工程研究所提供,樣品呈綠色粉狀,試驗時用蒸餾水配製成所需濃度的混懸液。
1.2 試驗動物
昆明種小鼠,SD大鼠由四川省抗菌素工業研究所提供。整個實驗,動物自由攝食和飲水,室溫20~25℃,相對溫度60~75%。
1.3 急性毒性試驗
均按霍恩氏(Horn)法設計劑量。
1.3.1 小鼠急性毒性試驗
選用昆明種小鼠,設1000、2150、4640和10000mg/(kg•bw)4個劑量組。
1.3.2 大鼠急性毒性試驗
選用SD大鼠,設2150、4640、10000和21500mg/(kg•bw)4個劑量組。
1.4 遺傳毒性試驗
1.4.1 Ames試驗 菌株為TA97、TA98、TA100和TA102,由四川省衛生防疫站提供,鑒定符合要求後進行試驗。Sg、2-AF及MMC等均由華西醫科大學提供,所有試劑皆為分析純。
1.4.2 骨髓微核試驗
選用昆明種小鼠,雌雄分開,設625、1250和2500mg/(kg•bw)3個劑量組。另設陰性對照組(0.85%NaCl)和陽性對照組環磷酰胺(30mg/(kg•bw)CP)。
1.4.3 小鼠精子畸形試驗
設625、1250和2500mg/(kg•bw)3個劑量組,另設0.85%NaCl和環磷酰胺分別作陰性對照和陽性對照組。
1.4.4 骨髓細胞染色體畸變試驗
選用昆明種小鼠,設500、1000和2000mg/(kg•bw)3個劑量組,另設0.85%NaCl(陰性對照)和陽性對照組(30mg/(kg•bw)CP)。
1.5 30天餵養試驗
選用SD大鼠,體重130~160g,將動物隨機分為4組。設300、1200和5000mg/(kg•bw)3個劑量組(分別相當於成人推薦劑量3g/d•人的6、24和100倍)以及蒸餾水對照組。
1.6 傳統致畸試驗
健康成熟的未交配SD大鼠,夜間按雄雌1∶2合籠,次日檢查是否交配。將查出的「孕鼠」隨機分為4組。設300、1200和5000mg/(kg•bw)3個劑量組和蒸餾水陰性對照組。
2 結果
2.1 急性毒性試驗
2.1.1 小鼠急性毒性試驗
按前述方法進行實驗,觀察期14d內,雌鼠、雄鼠均無死亡,其對雌雄鼠的LD50均大於10000mg/kg體重。
2.1.2 大鼠急性毒性試驗
按前述方法進行實驗,觀察期14d內,雌、雄鼠動物死亡情況為0、0、3和5只,死亡時間為2~5d,屍解胃內充滿受試物,未見其它臟器異常。查表得LD50為9260mg/(kg•bw),95%可信區間為6360~13500mg/(kg•bw)。按急性毒性(LD50)分級標準屬實際無毒級。
2.2 遺傳毒性試驗
2.2.1 Ames試驗
由表1可知,各劑量組在加與不加Sg的條件下每皿回變菌落數均未超過對照組的兩倍,也不存在劑量關係。故按Ames試驗評價標準,明日葉保健茶Ames試驗結果為陰性。
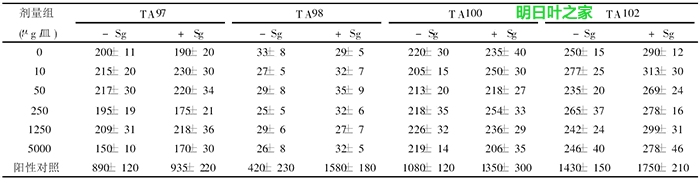
* 陽性物: – Sg、TA97、T A98、T A100為4-硝基喹啉氧( 0. 5μg /皿) , TA102為M MC ( 0. 5μg /皿) , + Sg、TA97、TA98、T A100均為2-AF ( 10μg /皿) , TA102為順鉑( 20μg /皿)。
2.2.2 小鼠骨髓嗜多染紅細胞微核試驗
在所設劑量2500、1250和625mg/(kg•bw)範圍內,雄鼠PCE微核率為2.80‰、2.80‰、2.40‰與陰性對照(2.20‰)比較(i2檢驗),差異無顯著性(P>0.05)。雌性PCE微核率為3.00‰、2.20‰和2.60‰,與陰性對照(2.40‰)比較(i2檢驗),差異無顯著性(P>0.05)。微核試驗結果為陰性。
2.2.3 小鼠精子畸形試驗
在所設劑量625、1250和2500mg/(kg•bw)範圍內,所得精子畸形率分別為2.35%、2.90%和2.70%與陰性對照(2.65%)比較(i2),差異無顯著性(P>0.05)。
2.2.4 小鼠骨髓細胞染色體畸變試驗
在所設劑量625、1250和2500mg/(kg•bw)範圍內,雄性組的骨髓細胞染色體畸變發生率為3.40%、4.00%和3.80%與陰性組(3.60%)比較(i2),差異無顯著性(P>0.05)。雌性組為3.20%、3.60%和3.80%與陰性組(3.80%)比較(i2),差異無顯著性(P>0.05)。
2.3 30d餵養試驗
2.3.1 動物生長狀況及血液學指標的檢測
溶劑對照組與3個劑量組動物在30d染毒期間,攝食、飲水、大小便正常,平均增重和平均食物利用率差異無顯著性。對照組和300、1200、5000mg/(kg•bw)3個劑量組平均血紅蛋白含量(g/L)分別為128.0、129.5、129.2、127.4;白細胞計數(×109/L)分別為11.2、12.1、12.5、11.8;紅細胞計數分別為(×1012/L)6.2、6.1、6.2、6.0。經統計學處理(t檢驗),各組動物血紅蛋白含量,白細胞計數及紅細胞計數差異無顯著性(P>0.05)。
2.3.2 生物化學指標的影響
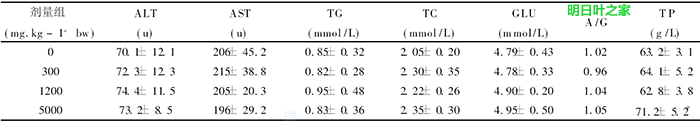
餵養結束後,各組動物的谷丙轉氨酶(ALT)、穀草轉氨酶(AST)、白蛋白/球蛋白比(A/G)及甘油三酯(TG)、總蛋白(TP)、總膽固醇(TC)、血漿葡萄糖(GLU)等指標中,僅高劑量組的總蛋白(TP)與溶劑對照組比較有顯著增加(F檢驗,P<0.01),肝TP合成量增加是有益的生物反應,其它各項指標與陰性對照組比較差異無顯著性(P>05)。見表2。
2.3.3 病理學檢查
大鼠各劑量組主要臟器系數(肝、腎、胸腺、心、脾臟)與溶劑對照組比較差異均無顯著性(P>0.05)。在對肝、腎、肺、胃、腸、脾臟和腺的組織病理學檢查中,各劑量組臟器均未見異常改變。
2.4 傳統致畸試驗
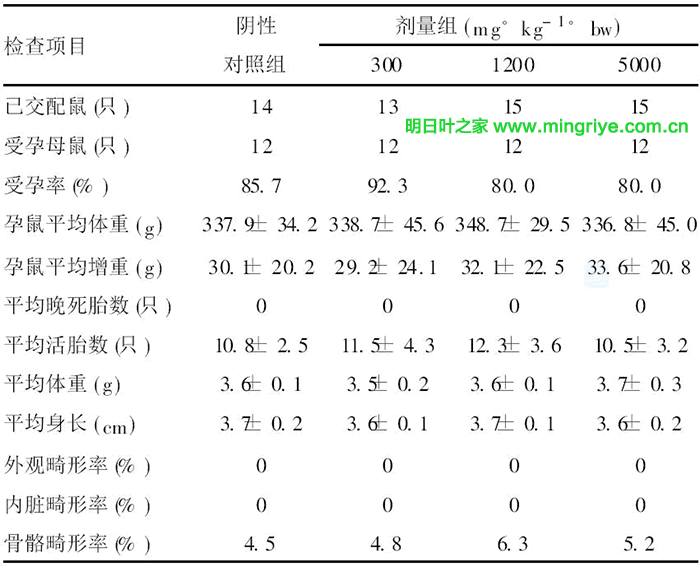
各劑量組孕母鼠平均體重和平均增重與陰性組比較差異均無顯著性(P>0.05);各劑量組的平均晚死胎數、平均活胎數和平均體重、平均身長以及外觀、內臟及骨髓畸形率與陰性組比較差異無顯著性(P>0.05),見表3。
3 討論
按照《食品安全性毒性學評價程序和方法》的要求,我們對明日葉保健茶的毒性進行了第一、二階段的檢測和研實際無毒級;Ames試驗、微核試驗、小鼠精子畸形試驗及骨髓細胞染色體畸變試驗等試驗結果均為陰性,據此可以認為其潛在的遺傳毒性作用較小,在30d餵養試驗中,未見引起大鼠的整體健康狀況、生理生化功能和器官組織形態學各重要指標的異常變化;在傳統致畸試驗中未見發育毒性和致畸性。綜上所述,可以認為「明日葉保健茶」在推薦劑量3g/(d•人)下,食用是安全的。為了人群的健康,筆者認為,可在保健功能法》[2]的檢測及流行病學調查的基礎上早日進行研制和開發。
[參考文獻]
[1]中華人民共和國衛生部.中華人民共和國國家標準GB15193-94[S].食品安全性毒理學評價程序和方法[A],1994.
[2]嚴衛星.《保健食品功能評價程序和檢驗方法》的有關技術問題[J].中國食品衛生雜誌,1999,11(2):17-21.

發佈留言